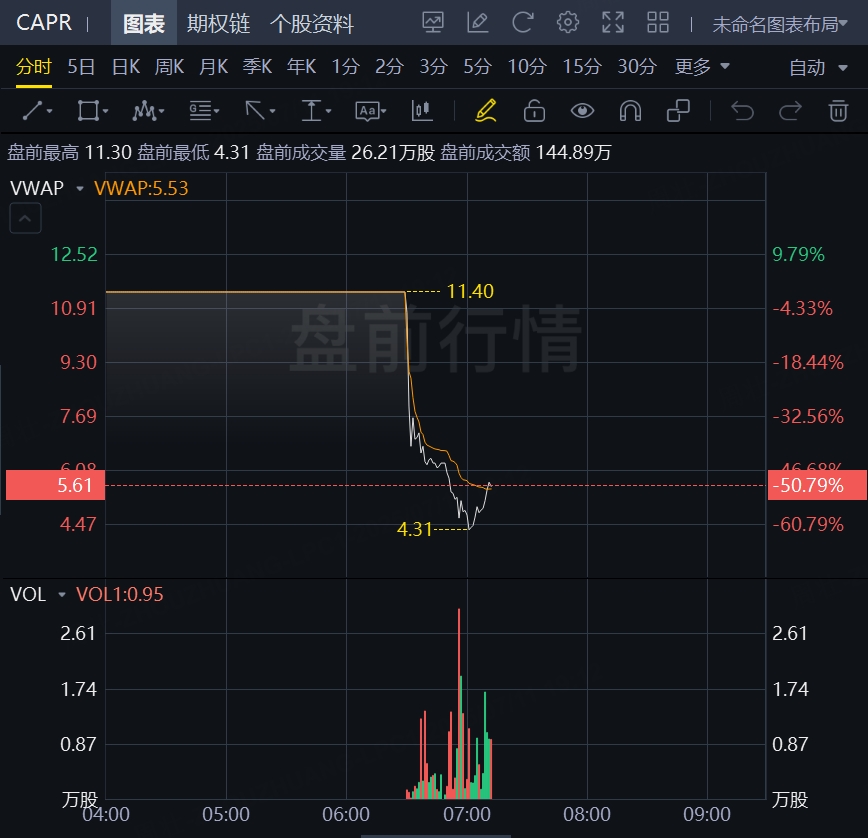
7月11日,生物醫藥股Capricor盤前暴跌逾50%!FDA拒絕其杜氏肌營養不良症藥物申請。
FDA表示,該生物製品許可申請(BLA)"不符合有效性實質性證據的法定要求",需要額外的臨牀數據。該機構還指出存在未解決的化學、製造和控制(CMC)問題,儘管Capricor認為在之前的溝通中已解決了大部分這些問題。
Capricor首席執行官Linda Marbán對這一決定表示驚訝,她指出"在收到完整回覆函之前,審查過程進展順利,包括成功完成了上市前檢查和中期審查。"該公司的申請於2025年3月獲得了優先審查資格。
這家生物技術公司現計劃重新提交其生物製品許可申請,並附上正在進行的HOPE-3三期臨牀試驗數據,預計將在2025年第三季度產生初步結果。HOPE-3研究是一項隨機、雙盲、安慰劑對照試驗,涉及104名患者。
FDA已向Capricor提供機會,請求召開A類會議,討論獲得潛在批准的下一步措施。該公司仍專注於追求治療與DMD相關的心肌病適應症。
Capricor的原始申請包括HOPE-2試驗數據、其開放標籤擴展研究以及來自FDA資助數據集的自然病史比較,但這些最終被證明不足以獲得批准。