智通財經APP獲悉,3月18日,CDE發布了《2024 年度藥品審評報告》,2024 年,藥審中心全年批准上市 1 類創新藥 48 個品種,其中 17 個品種(35.4%)通過優先審評審批程序批准上市,11 個品種(22.9%)附條件批准上市,13 個品種(27.1%)在臨牀試驗期間納入了突破性治療藥物程序。
藥品註冊申請審評審批情況
全年批准罕見病用藥 55 個品種(未包括化學藥品 4 類仿製藥),其中 20 個品種(36.4%)通過優先審評審批程序加快上市,2 個品種附條件批准上市。
全年批准兒童用藥 106 個品種,包含 71 個上市許可申請,其中 20 個品種(18.9%)通過優先審評審批程序加快上市;另批准 35 個品種擴展兒童適應症。
全年批准境外已上市境內未上市的藥品(化學藥品 5.1 類、治療用生物製品 3.1 類和預防用生物製品 3.1 類)89 個品種,其中 64 個為首次批准上市,25 個為已上市藥品增加適應症。
突破性治療藥物程序
2024 年共收到突破性治療藥物程序申請 337 件,同意納入突破性治療藥物程序 91 件(84 項適應症),佔申請數量的 27.00%,較 2023 年增加 30.00%。
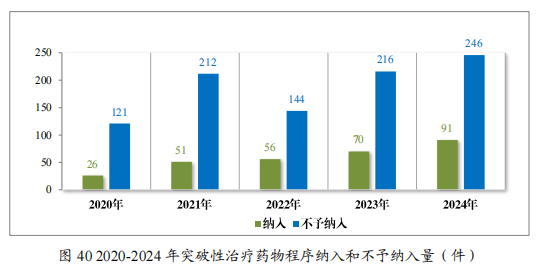
自 2020 年《藥品註冊管理辦法》(總局第 27 號令)實施以來,累計納入突破性治療藥物程序 294 件(246 項適應症),排名前三的分別為抗腫瘤藥物、神經系統疾病藥物及抗感染藥物,具體適應症分佈情況請見下圖。

附條件批准程序
2024 年共有 37 件藥品註冊申請(27 項適應症)附條件批准上市,其中 18 項適應症為首次批准上市,9 項適應症為已上市藥品增加適應症。同時,在 2024 年,共有 9 項附條件批准的適應症完成確證性研究,轉為常規批准。
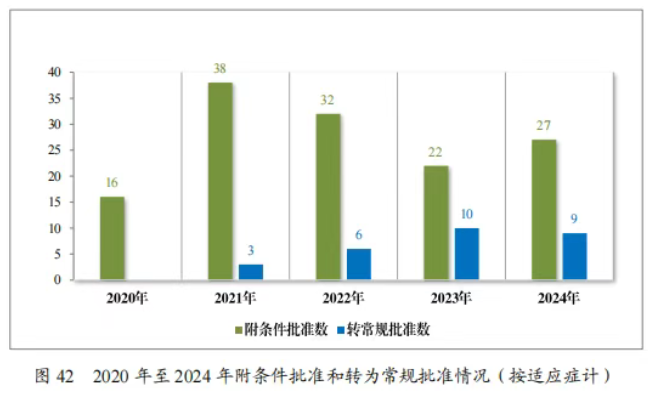
自 2020 年《藥品註冊管理辦法》(總局第 27 號令)實施以來,共有 187 件藥品註冊申請(135 項適應症)附條件批准上市,包括抗腫瘤藥物、新冠疫苗及治療藥物、血液系統疾病藥物等,其中抗腫瘤藥物數量最多,佔比 82.22%,共有 28 項附條件批准的適應症完成確證性研究,轉為常規批准。

優先審評審批程序
根據報告,適用優先審評審批程序的上市註冊申請的審評時限由常規程序的 200 日縮短為 130 日,其中臨牀急需境外已上市罕見病用藥的審評時限為 70 日。
2024 年共納入優先審評審批註冊申請 124 件(88 個品種),按年增加 14.81%;2024 年按照優先審評審批程序批准 110 件註冊申請(74 個品種,其中 2 個品種新準上市後,同年又批准新適應症)上市,按年增加 29.41%。

自 2020 年《藥品註冊管理辦法》(總局第 27 號令)實施以來,共有 496 件藥品註冊申請納入優先審評審批程序,包括抗腫瘤藥物、皮膚及五官科藥物、內分泌系統藥物等,其中抗腫瘤藥物數量最多,佔比 42.54%。