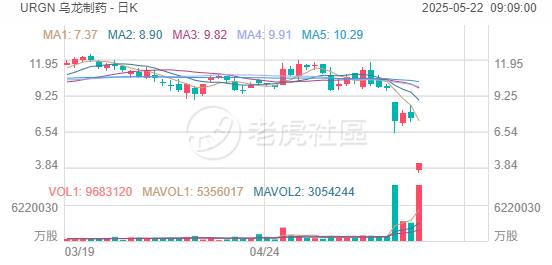
周三,烏龍製藥股價暴跌逾44%,此前美國食品藥品監督管理局(FDA)顧問委員會對該公司的膀胱癌療法UGN-102(絲裂黴素)投下反對票,這款藥物目前正在美國接受監管審查。
在針對膀胱內注射溶液的風險獲益比問題上,FDA腫瘤藥物顧問委員會(ODAC)以4票讚成、5票反對的結果否決了該藥物。這對正尋求UGN-102美國批准的烏龍製藥來說是重大挫折。
去年10月,FDA受理了該公司關於UGN-102用於治療複發性低級別中危非肌層浸潤性膀胱癌(LG-IR-NMIBC)的新藥申請(NDA),並將2025年6月13日定為目標行動日期。
烏龍製藥醫療主管馬克·舍恩伯格(Mark Schoenberg)表示:「LG-IR-NMIBC是一種高複發性疾病,許多老年患者往往需要在全身麻醉下反覆接受手術。這是一個未滿足的需求極高的領域,我們相信患者理應獲得更多治療選擇。」他補充道。
FDA顧問委員會的建議不具約束力,但監管機構通常會在做出最終批准決定前參考這些意見。