眼科藥物開發歷來被稱為「黃金賽道」,已上市產品可通過延長專利期,或開發更多新適應症以擴大市場,保持優勢地位。
據弗若斯特沙利文報告披露,目前全球眼科藥物市場快速增長,市場規模由2018年324億美元增加至2022年的387億美元,預計2027年達到570億美元,於2032年將達到858億美元,摺合人民幣來看,這也算千億賽道了。
伴隨着眼科賽道的高景氣,想要躋身資本市場「眼科大軍」的不知凡幾。
根據智通財經APP了解,據港交所6月11日披露,CLOUDBREAK PHARMA INC.(撥康視雲)第四次向港交所主板提交上市申請書,建銀國際、華泰國際為其聯席保薦人。該公司曾於2023年11月、2024年5月、2024年12月2日向港交所提交過上市申請書。
招股書顯示,撥康視雲是一間臨牀階段眼科生物科技公司,致力於開發各種療法。眼科是研究眼部結構、功能和疾病的醫學分支。撥康視雲首家主要營運實體Cloudbreak USA於2015年9月在美國註冊成立及公司於2020年11月在開曼羣島註冊成立。
目前,該公司已獲四輪孖展,孖展額約1.54億美元,投資機構包括高特佳、建銀國際、鼎暉投資、遠大醫藥等。C輪孖展過後,撥康視雲估值達到4.69億美元,相當於36.6億港元。
三年累計虧損2.95億美元
撥康視雲是一間臨牀階段眼科生物科技公司,致力於開發各種療法。眼科是研究眼部結構、功能和疾病的醫學分支,目前已經建立一個由候選藥物組成的創新的管線,覆蓋眼睛前部和後部的主要疾病,其中有四款處於臨牀階段的候選藥物及四款處於臨牀前階段的候選藥物,管線中的所有候選藥物均為自主研發。
公司的管線包括兩款核心產品(CBT-001及CBT-009),均為自主開發。核心產品CBT-001適用於治療翼狀胬肉(一種良性增生性眼表疾病),公司分別於2022年6月及 2023年9月在美國及中國啓動第3期多地區臨牀試驗(「多地區臨牀試驗」)。
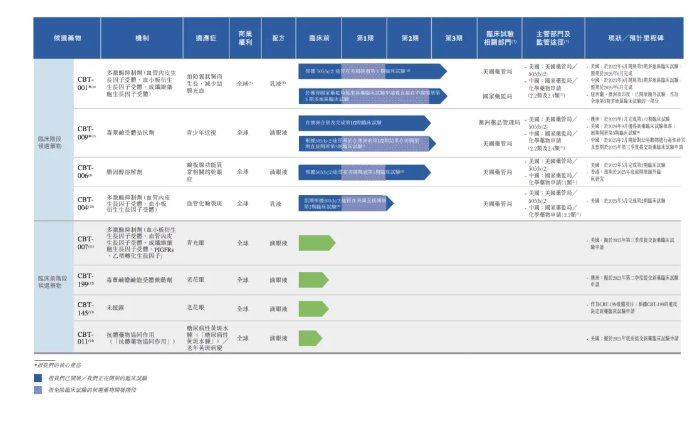
核心產品 CBT-009用於治療青少年近視(5至19歲兒童及青少年近視),於2023年1月完成第1/2期 臨牀試驗,並於2024年7月向美國食品及藥物管理局(「美國藥管局」)提交研究新藥(「研究新藥」)申請。公司擁有其他兩個臨牀階段候選藥物CBT-006及CBT-004,及四款臨牀前階段候選藥物CBT-007、CBT-199、CBT-145以及CBT-011。
從上述招股書披露來看,公司產品均處於臨牀試驗階段。
從業績來看,撥康視雲是一間尚未錄得收益的生物科技公司,其自成立以來及於整個往績記錄期產生淨虧損,同時公司稱可能於不久將來繼續產生虧損,且可能無法實現或維持盈利能力。
數據顯示,2022年、2023年及2024年(以下簡稱「報告期」),撥康視雲年內虧損分別約為0.67億美元、1.29億美元、0.99億美元,三年虧損2.95億美元,約合21.2億元人民幣。
同時撥康視雲在招股書中披露,預計2025年虧損淨額將增加,主要是因為與將作出的以股份為基礎的付款增加有關的員工成本預期增加等。
招股書顯示,公司幾乎所有虧損均來自其一般及行政開支、研發開支及按公平值計入損益的金融負債以及衍生金融工具的公平值變動。
據招股書,撥康視雲一般及行政開支由2023年的0.11億美元減少約180萬美元或15.9%至2024年的約950萬美元。
虧損背後,撥康視雲仍在不斷加碼研發。
報告期內公司研發開支持續增長,分別為0.15億美元、0.28億美元及0.38億美元。同年,核心產品CBT-001及CBT-009的臨牀研究開支分別為約760萬美元、890萬美元及1980萬美元,分別佔各期研發開支的49.4%、32.3%及52.2%,佔各期營運成本總額31.2%、22.9%及41.8%。
與此同時,撥康視雲期內經營活動的現金流量持續為負數,報告各期公司經營活動分別錄得負現金流量約2010萬美元、2250萬美元及2650萬美元。
根據智通財經APP了解,撥康視雲整個經營史均需靠外部孖展。然而由於C輪孖展之後再沒有獲得新孖展,導致其「外債」也越來越高。招股書還顯示,撥康視雲期內錄得負債淨額及流動負債淨額,使其面臨流動資金風險。公司報告期各期負債總額分別為2.27億美元、3.28億美元及3.92億美元;流動負債淨額分別為1.47億美元、2.66億美元及3.54億美元,均持續上升。
總之,越虧越多,拖累撥康視雲的各項財務指標陷入惡性循環,再度逐夢港股恐怕過程不易。
核心產品商業化前景難言明朗
正如上文所言,撥康視雲已有四款處於臨牀階段的候選藥物,分別為CBT-001、CBT-009、CBT-006和CBT-004。上述產品一旦上市,撬動的成長空間恐怕也不容小覷。
在研管線中,CBT-001為撥康視雲最成熟的核心產品,公司已於美國開展第3期多地區臨牀試驗患者招募工作並完成中國臨牀試驗機構挑選。CBT-001截至最後實際可行日期,並無臨時數據可供分析。且公司預期美國及中國的第3期多地區臨牀試驗將於2025年底完成。
弗若斯特沙利文報告顯示,CBT-001對應的全球治療翼狀胬肉藥物的市場規模預計將於2027年達到273.4百萬美元及於2032年達到2,529.4百萬美元,複合年增長率為56.0%。美國治療翼狀胬肉藥物的市場規模預計於2027年達到135.9百萬美元及於2032年達到1,416.6百萬美元,複合年增長率為59.8%。中國治療翼狀胬肉藥物的市場規模預計於2027年達到21.8百萬美元及於2032年達到202.2百萬美元,複合年增長率為56.1%。
截至最後實際可行日期,全球有3款適用於翼胬肉及減少結膜充血的臨牀階段候選藥物,其中2款處於第2期臨牀試驗階段及其中1款處於第3期臨牀試驗階段,即CBT-001。

然而,作為距離商業化最近的產品CBT-001,撥康視雲已將部分權益讓渡給遠大醫藥。
招股書顯示,2020年4月,撥康視雲與遠大醫藥簽訂了一份商業化許可安排,授予遠大醫藥在大中華區生產和商業化CBT-001的獨家、可轉授權、含專利權費的許可,該許可適用於CBT-001的所有人類用途(包括預防翼狀胬肉發展和減少結膜出血)。
而撥康視雲則保留了上述地區上述適用領域以外CBT-001有關的所有權利,以及CBT-001的任何研發將由撥康視雲進行,遠大醫藥在未取得事先書面同意前不參與CBT-001的任何研發或就此作出貢獻。不可否認的是,將部分權益讓渡給遠大醫藥可能會加速CBT-001的商業化進程,但另一方面,也會降低CBT-001對於撥康視雲的盈利水平。更為重要的是,CBT-001的商業化最早也要在2025年以後,遲遲無法輸血的撥康視雲能等到嗎?
綜上來看,當下捉襟見肘的資金情況成為懸在公司頭頂的一把利劍。如此情況更使得撥康視雲衝刺IPO,成為一場不能輸的戰役。