據港交所6月29日披露,BlissBio Inc.(簡稱:百力司康)向港交所主板遞交上市申請,高盛、華泰國際及建銀國際為聯席保薦人。
據招股書披露,百力司康是一家處於臨床階段的生物製藥公司,致力於開發下一代抗體偶聯藥物(ADC),以解決目前腫瘤治療中重要的未滿足的需求。公司從戰略角度出發,設計並推進由四個處於臨床階段的候選藥物組成的ADC管線。公司核心產品BB-1701(核心產品)是一種人類表皮生長因子受體2(HER2)靶向型艾立布林ADC候選藥物,主要針對乳腺癌(BC)、非小細胞肺癌(NSCLC)和潛在的其他HER2表達癌症。
除核心產品外,公司還有其他三種處於臨床階段的ADC:BB-1705 (一種表皮生長因子受體(EGFR) ADC)、BB-1712(一種抗B7同源蛋白3(B7-H3) ADC)和BB-1709(一種分化簇73(CD73)ADC),它們在廣泛的適應症方面具有潛力。公司的所有管線資產都擁有完全的全球權利。
BB-1701是全球臨床階段最靠前的針對或用於TOP1-i ADC經治患者的HER2 ADC候選藥物。艾立布林作為一類在70多個國家上市的腫瘤療法,BB-1701採用艾立布林作為ADC有效載荷,利用艾立布林的多方面作用機制、差異化耐藥機制及其在全球70多個國家獲批用於腫瘤治療的臨床驗證療效及安全性。根據目前在美國、歐洲、日本及中國進行的2期研究,BB-1701已經顯示具有令人鼓舞的療效以及可控的安全性,尤其是在260名患者中只有三例ILD(兩例1級,一例2級),較優赫得®有所改善。
公司的內部化學、製造和控制(CMC)開發及製造能力在抗體開發、偶聯工藝、製劑配方及ADC構建方面提供高品質、高效率及具有成本效益的解決方案的能力而言乃屬不可或缺。憑藉「工藝即產品」的原則,制定穩健的生產流程,並確保在整個開發周期均實施嚴格品質控制及保證。該等能力使公司能夠在14個月的時間內,將項目從一個臨床前候選推進至研究中新藥臨床研究申請(IND)狀態,根據弗若斯特沙利文的資料,此進度遠快於18個月的行業平均水平。美國、中國、歐盟和日本等全球監管機構授予的多個IND批准證明了公司CMC平台的能力。
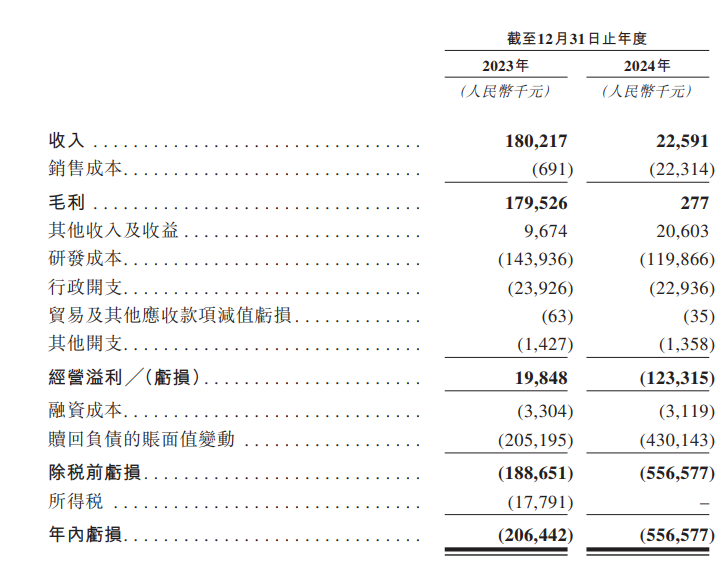
財務方面,於2023年度、2024年度,百力司康實現收入分別約為1.8億元、2259.1萬元人民幣;同期年內虧損分別約為2.06億元、5.57億元人民幣。