港股異動|雲頂新耀漲超8%,IgA腎病對因藥耐賦康®擴產獲國家藥監局批准
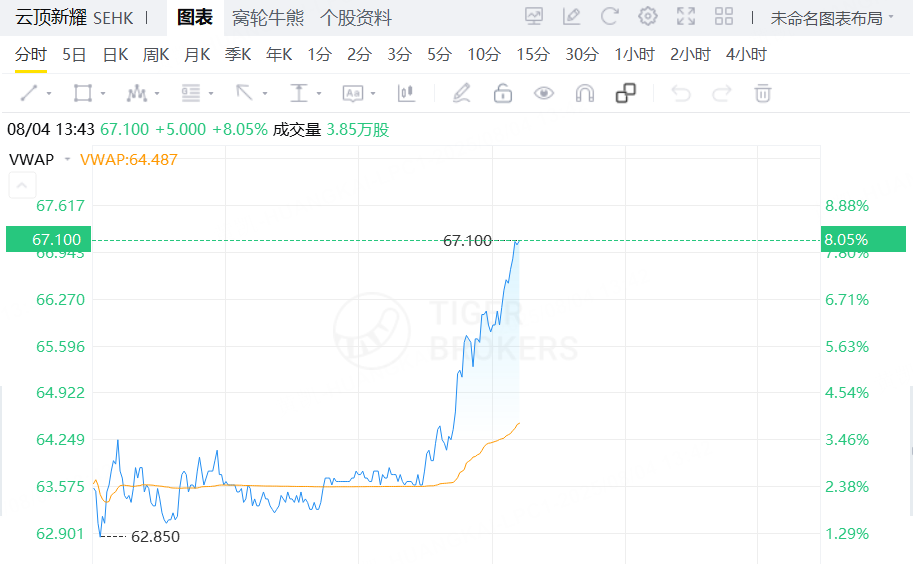
8月4日,雲頂新耀盤中漲超8%,消息方面:IgA腎病對因藥耐賦康®擴產獲國家藥監局批准。
2025年8月4日,雲頂新耀(01952)宣佈,其中國首個且唯一獲得完全批准的IgA腎病對因治療藥物耐賦康®(布地奈德腸溶膠囊)擴產補充申請已正式獲得中國國家藥品監督管理局批准。作爲全球首個且目前唯一在中國、美國和歐洲獲得完全批准的IgA腎病對因治療藥物,耐賦康®已成爲IgA腎病治療的一線基石藥物,此次擴產獲批將進一步提升產能,增加產品供應,更高效地響應中國及亞洲地區對耐賦康®的持續增長的臨牀需求。
雲頂新耀首席執行官羅永慶表示:“本次產品生產產能的提高,將更好滿足亞洲地區IgA腎病患者日益增長的臨牀治療需求。IgA腎病在亞洲高發,其中中國是全球原發性腎小球疾病發病率最高的國家之一,估計目前有超過500萬名IgA腎病患者,每年新增確診患者超過10萬例。中國IgA腎病患者的疾病進展快、預後差,臨牀尚存在巨大未滿足的治療需求。
作爲目前唯一獲國內外指南共同推薦的IgA腎病對因治療藥物,耐賦康®的擴產將加速對因治療的普及,助力更多患者儘早開啓規範治療、延緩疾病進展、保護腎功能。我們也將持續推動耐賦康®的可及性與可負擔性,加速其從‘改變治療格局’邁向‘重塑治療標準’。”
耐賦康®通過特異性調節腸道黏膜免疫,減少誘發IgA腎病的半乳糖缺陷的IgA1(Gd-IgA1)產生,從而阻止下游的病理途徑,最終有效控制蛋白尿並保護腎功能。在全球III期NefIgArd研究中,耐賦康®能使腎功能下降風險降低50%,中國人羣數據分析顯示,能減少66%腎功能下降,疾病進展至透析或腎移植的時間延緩12.8年。
耐賦康®於2023年11月通過優先審評程序正式獲得NMPA的批准,用於治療具有進展風險的原發性IgA腎病成人患者,填補了國內從疾病源頭治療IgA腎病的空白,並在2024年11月被納入國家醫保藥品目錄,2025年5月獲得NMPA完全批准,取消了對蛋白尿水平的限制,適用於絕大部分IgA腎病患者的治療。
憑藉創新的作用機制和突出的臨牀優勢,耐賦康®先後被納入《2024版KDIGO IgA腎病和IgA血管炎臨牀管理實踐指南(公開審查版)》以及《中國成人IgA腎病及IgA血管炎臨牀實踐指南(預審版本)》,成爲目前唯一同時獲國際與國內指南推薦的IgA腎病對因治療藥物。這不僅改變了傳統的IgA腎病治療方案,對因治療和支持治療需同時進行,並確立了耐賦康®作爲IgA腎病一線治療的基石地位。目前,耐賦康®已在雲頂新耀所有授權區域(包括中國大陸、中國香港、中國澳門、中國臺灣、新加坡及韓國)獲得批准。
免責聲明:投資有風險,本文並非投資建議,以上內容不應被視為任何金融產品的購買或出售要約、建議或邀請,作者或其他用戶的任何相關討論、評論或帖子也不應被視為此類內容。本文僅供一般參考,不考慮您的個人投資目標、財務狀況或需求。TTM對信息的準確性和完整性不承擔任何責任或保證,投資者應自行研究並在投資前尋求專業建議。
熱議股票
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- 10