導語:諾華已成為新型靶向放射療法領域的先行者。
首批見證新型靶向放射療法掃描結果的醫生與藥物研發人員均倍感驚歎,在臨床試驗中,部分患者接受諾華(Novartis)的放射性配體療法僅六個月,全身擴散的癌細胞便被徹底清除。
紀念斯隆・凱特琳癌症中心(Memorial Sloan Kettering Cancer Center)的腫瘤學家邁克爾・莫里斯表示,這一成果 「令人難以置信」,且 「前所未有」。在他參與的首次試驗中,約 9% 的參與者掃描結果顯示癌細胞完全消失;而在第二次試驗中,這一比例升至 21%。
他指出:「我們尚無法治癒轉移性疾病,但在多數情況下,現有治療手段也無法改變掃描中疾病的呈現狀態。而我們此次研發的療法則截然不同。」
諾華涉足癌症藥物研發已數十年,通過兩筆交易收購相關技術後,它成為了放射性配體療法領域的先行者。2017 年,諾華收購了先進加速器應用公司(Advanced Accelerator Applications),該公司由歐洲核子研究組織的科學家創立。次年,諾華宣佈以 21 億美元收購美國生物技術公司恩多賽特(Endocyte)。
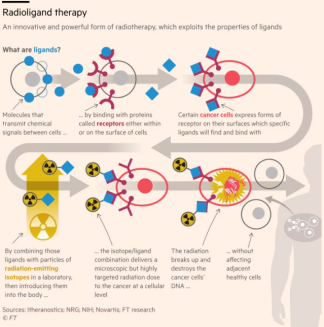
放射療法目前用於約半數癌症患者的治療,其通常從體外施照以殺滅癌細胞,但過程中會損傷健康組織。
放射性配體療法則以靜脈輸注的方式給藥,輸注液中含有附着在配體上的放射性同位素。配體是能與癌細胞表面受體結合的分子,藉助這種結合,可向癌細胞精準遞送放射劑量。
盧瑟特拉(Lutathera),是諾華在收購先進加速器應用公司的交易中獲得的一款放射性配體療法藥物,於 2017 年首次獲批用於治療部分胃腸道癌症。
2022 年,諾華的前列腺癌藥物普盧維託(Pluvicto)首次獲得美國批准,此後其適應症範圍擴大至早期患者。
2021 年,諾華首席執行官瓦斯・納拉西姆漢(Vas Narasimhan)預估該療法對應的市場規模約為 100 億美元。今年早些時候,他向FT表示,若該療法能達到預期效果,其市場規模有望達到 250 億至 300 億美元。
他稱:「我們認為存在一系列獨特靶點,而這些靶點我們認為只有通過放射性配體療法才能靶向作用。」
然而,這種前景廣闊的療法面臨着重大的物流挑戰。放射性同位素必須在覈反應堆中製造,隨後放射性藥物需經過安全生產、運輸,最終送達患者手中。
諾華多年來一直致力於克服這些障礙。但其他企業也看到了該療法的機遇,正競相追趕。2023 年至 2024 年間,美國製藥商禮來(Lilly)、英國製藥公司阿斯利康(AstraZeneca)以及法國企業賽諾菲(Sanofi)均收購了從事放射性配體療法研發的初創公司。
諾華放射性配體療法化學部門執行董事菲利普・霍爾澤(Philipp Holzer)表示,如今從事該領域的企業如 「雨後春筍般湧現」,同位素供應商也日益增多。他說:「當前正形成一個全新的市場。」
諾華有 7 種潛在的放射性配體療法處於 15 項臨床試驗階段,另有更多療法處於臨床前測試階段。該公司正探索不同的同位素、療法組合,並將適應症拓展至肺癌、乳腺癌、胰腺癌和結腸癌等其他癌症類型。
諾華表示,若該療法能達到預期效果,其市場規模有望達到 250 億至 300 億美元(約人民幣1800億元-2100億元)
在巴塞爾(Basel)的諾華園區內,主要的放射性配體實驗室必須經過加固處理,以便安裝 40 噸鉛板,防止輻射泄漏到建築其他區域。所有在實驗室工作的科學家都佩戴兩個劑量計,其中一個小型劑量計戴在手指上,用於監測輻射暴露量。
科研人員正努力尋找方法,讓該療法適用於更廣泛的癌症類型。這包括研發能與腫瘤中常見但在其他部位不存在的基因突變相結合的藥物,以避免健康組織受到輻射影響。
納拉西姆漢(Narasimhan)表示:「針對每種癌症類型,都需要獨特的解決方案。人體內部幾乎沒有‘即插即用’的情況,我們必須攻克各種挑戰。」
一旦新型放射性配體療法獲批,大規模生產便成為新的挑戰。諾華已收購了大量放射性同位素鑥的供應,因此其他企業正尋求錒等替代同位素。由於錒的供應大部分來自俄羅斯,這些企業也在其他地區尋找貨源。
放射性材料製成後,公司僅有 3 至 5 天時間生產藥物並送達患者手中,否則同位素衰變會導致藥效降低。每一瓶藥物都是為特定患者定製的,並根據其計劃治療日期進行製備。諾華表示,此前公司在滿足普盧維託(Pluvicto)的需求方面面臨困難,但目前 99.5% 的注射都能按計劃進行。
2022 年,這家瑞士製藥商的前列腺癌藥物普盧維託(Pluvicto)首次獲得美國批准。
諾華運營總裁斯特芬・朗(Steffen Lang)表示,同位素必須以合適的濃度與靶向癌細胞的分子結合,隨後還需進行質量檢測。「這不僅要快速,還必須一次成功。」
之後,有專門團隊全天候追蹤帶有 GPS 定位的藥瓶。諾華正開始運用生成式人工智能(generative AI),助力預測物流問題並選擇送往醫院的路線。為了更貼近醫院和患者,該公司計劃在目前歐美 6 家生產工廠的基礎上,在中國、日本和美國新增更多生產設施。
朗稱:「空中交通問題、惡劣天氣狀況,我們都遇到過。」
向患者施用放射性配體療法還面臨更多挑戰:與體外放射療法不同,放射性物質會留在患者體內,在給藥後持續發揮作用。在德國、日本等部分國家,患者必須在防輻射的醫院病房中隔離過夜。目前,能夠建造這類專業設施的企業寥寥無幾。
臨床醫生也需要接受培訓,學習如何照料這類患者。在部分國家,患者的尿液必須收集並儲存 70 天,直至其中的放射性物質衰變完畢。
資產管理公司馮託貝爾(Vontobel)的投資組合經理卡拉・本齊格(Carla Baenziger)—— 該公司是諾華的股東 —— 表示,儘管面臨諸多障礙,但此類靶向療法仍是 「癌症治療的未來」。
她指出,今年對諾華而言意義重大,部分原因是普盧維託(Pluvicto)獲得了適應症擴展批准,潛在患者羣體規模翻倍。但她認為,要建立起放射性配體療法成為主流療法所需的生態系統,仍需 10 至 15 年時間。
她說,諾華已克服了諸多難題,尤其是在擴大生產規模方面,這為 「其他競爭對手設定了較高的准入門檻」。
納拉西姆漢(Narasimhan)也認同諾華具備優勢。他表示:「像我們的一些同行那樣,通過收購生物技術公司進入該領域,確實能獲得一個起點。但要真正掌握這項技術,還需要大量的工作和投資。我們擁有五年的先發優勢。」(FT)
#生物醫藥 #抗癌 #諾華 #核反應堆