智通財經APP訊,歌禮制藥-B(01672)發布公告,該公司在2025年9月16日在奧地利維也納舉行的第61屆歐洲糖尿病研究協會(EASD)年會上的簡短口頭討論專場會議A中報告了其ASC30口服小分子GLP-1受體(GLP-1R)激動劑28天多劑量遞增(MAD)研究 (NCT06680440)隊列1和隊列2的結果。
該Ib期MAD研究是一項在美國開展的隨機、雙盲、安慰劑對照的研究,旨在評估 ASC30每日一次口服片在肥胖受試者(體重指數(BMI):30-40 kg/m2)中的安全性與耐受性、不同劑量遞增方案、藥代動力學(PK)特徵及初步療效。
在MAD隊列2(2毫克、10毫克、20毫克和40毫克,每周劑量遞增)中,ASC30 每日一次口服片顯示,經28天治療後,安慰劑校準後的相對基線的平均體重下降6.5%。在MAD隊列1(2毫克、5毫克、10毫克和20毫克,每周劑量遞增)中, ASC30每日一次口服片顯示,經28天治療後,安慰劑校準後的相對基線的平均體重下降4.5%。第29天未觀察到減重平台期跡象。
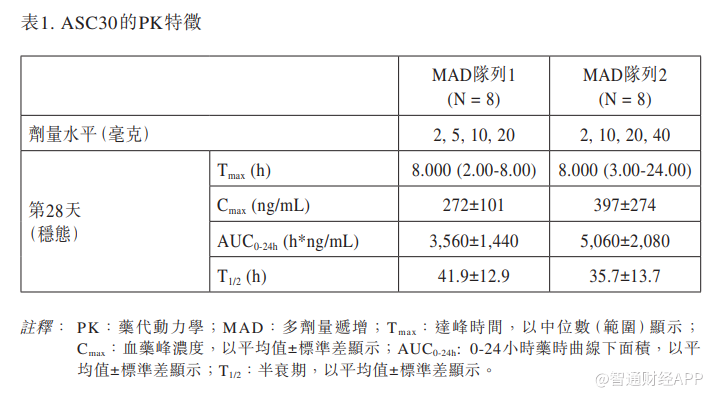
20毫克和40毫克ASC30在穩態時顯示出更優的口服PK特徵。更高的藥時曲線下面積(AUC)與更顯著的體重下降呈正相關。表1總結了ASC30的PK特徵。
ASC30安全性和耐受性良好,僅出現輕度至中度胃腸道(GI)不良事件(AE)。在28 天治療期及7天隨訪期內,MAD隊列1(2毫克、5毫克、10毫克和20毫克)的嘔吐發生率為零。雖然MAD隊列2(2毫克、10毫克、20毫克和40毫克)發生了嘔吐事件,但大部分發生於10毫克劑量遞增周期間,且在2毫克劑量遞增周未報告嘔吐事件。綜上所述,數據表明從2毫克逐周遞增至5毫克是一種適宜的遞增速度,並為IIa期研究設計的劑量遞增方案提供了關鍵依據。
未有報告嚴重不良事件(SAE),也未觀察到3級或以上AE。包括丙氨酸氨基轉移酶(ALT)、天冬氨酸氨基轉移酶(AST)和總膽紅素(TBL)在內的肝酶在治療期間均未升高。實驗室檢查、生命體徵、ECGs(心電圖,包括按心率校正的QT間期 (QTc))和體格檢查均未發現異常。