智通財經APP獲悉,據港交所9月30日披露,武漢濱會生物科技股份有限公司(簡稱:濱會生物)向港交所主板提交上市申請書,華泰國際、招銀國際和中銀國際為聯席保薦人。

招股書顯示,濱會生物是一家溶瘤病毒療法生物科技公司,致力於創新癌症免疫療法的發現、開發及商業化。公司旨在透過提供在療效及安全性方面優於標準治療的突破性溶瘤療法,應對全球迫切未滿足的臨牀需求。公司的工作由創始人兼董事會主席劉濱磊博士領導,彼於腫瘤免疫學及溶瘤病毒學領域擁有逾30年專業知識。劉博士為首個獲FDA批准的溶瘤病毒藥物IMLYGIC®(talimogene laherparepvec,或T-VEC)的塬研發團隊的核心成員,並且在該藥物的開發中發揮關鍵作用。
作為溶瘤病毒領域及其他領域的先驅,濱會生物已建立豐富且多元化的管線,包含五項處於不同開發階段的產品,其中多項產品具有全球同類首創的潛力。公司自主研發的核心產品 BS001(OH2注射液)是一款基於II型單純皰疹病毒(HSV-2)的新型溶瘤病毒候選藥物,其生物學改造使其能夠在腫瘤細胞內選擇性複製,直接引發溶瘤效應,並分泌人粒細胞 — 巨噬細胞集落刺激因子(hGM-CSF)以激活全身免疫活動。公司目前正在研究BS001作為單藥療法及以主要藥物作為聯合療法(尤其是與PD-1抑制劑聯合用藥),用於治療多種實體瘤適應症,其中包括黑色素瘤、結直腸癌、膠質母細胞瘤、軟組織肉瘤及膽道癌,而公司已在早期臨牀試驗中觀察到良好的安全性及初步療效。
濱會生物的BS001為全球首個達到臨牀階段並進入 III期關鍵試驗的以HSV-2為病毒骨架的溶瘤病毒候選藥物,有潛力成為全球首個獲批准的以HSV-2為病毒骨架的溶瘤病毒療法。BS001亦為首個獲藥品審評中心授予突破性療法認定的溶瘤病毒候選藥物。此外,BS001為首個及唯一一個獲FDA授予孤兒藥資格認定用於治療III期至IV期黑色素瘤的中國塬創溶瘤病毒候選藥物,以及首個獲FDA授予孤兒藥資格認定用於治療惡性膠質瘤的中國塬創以HSV-2為病毒骨架的溶瘤病毒候選藥物。
此外,BS001獲FDA授予快速通道資格認定,用於治療對抗 PD-1療法耐藥或在治療後進展的不可切除的III期或IV期黑色素瘤。公司已將BS001推進至中國黑色素瘤III期臨牀試驗,該試驗為隨機控制試驗,顯著採用主管監管機關認可的腫瘤學黃金標準療效終點總生存期作為主要終點。其已完成的Ia/Ib期試驗顯示中位總生存期延長至31.06個月;然而,隨着治療持續進行中,最終總生存期尚未達到,並預期將繼續延長。其亦呈報晚期黑色素瘤患者的客觀緩解率為34.48%,而對PD-1療法產生耐藥性的患者的客觀緩解率更高達42.1%。
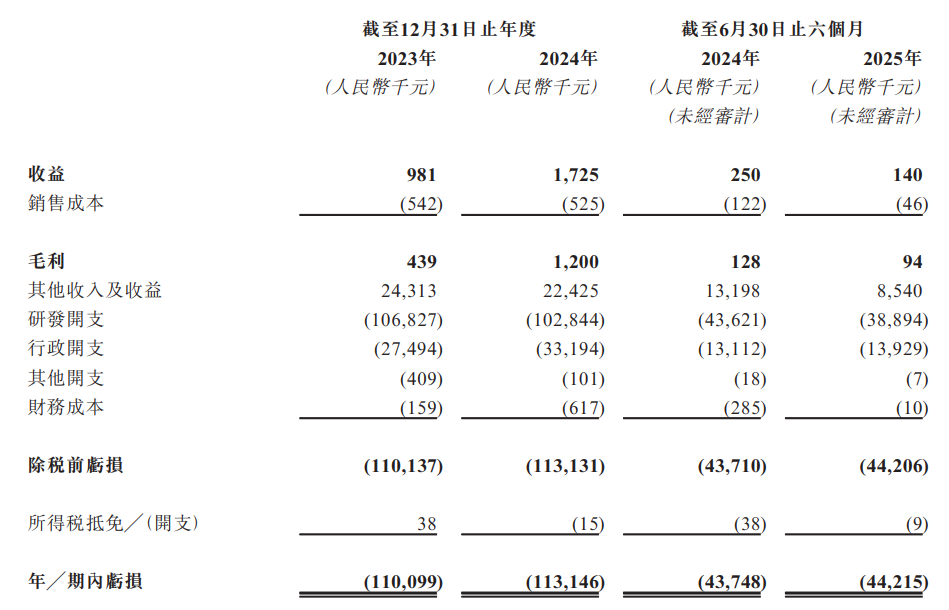
財務方面,於2023年度、2024年度、2024年及2025年截至6月30日止六個月,濱會生物實現收益分別為98.1萬元、172.5萬元、25萬元、14萬元人民幣;同期,年/期內虧損分別為約1.10億元、1.13億元、4374.8萬元、4421.5萬元人民幣。