智通財經APP獲悉,10月13日,CDE官網顯示,艾伯維(ABBV.US)注射用E型肉毒毒素(TrenibotE)上市申請獲受理,註冊分類為1類。根據公開資料和臨牀試驗進展,Insight數據庫推測適應症為中度至重度眉間紋。
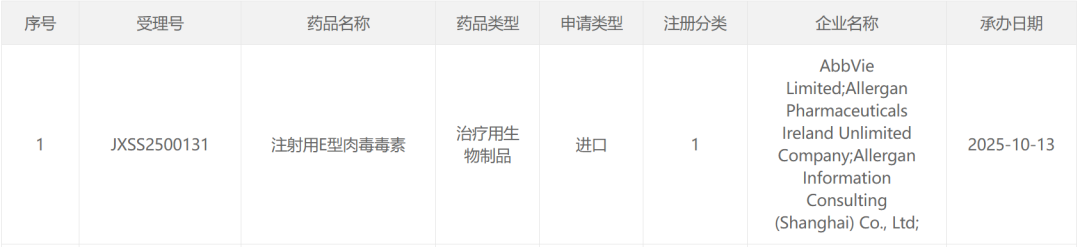
截圖來源:CDE官網
TrenibotE是同類首創的E型肉毒神經毒素,2025年4月,艾伯維向FDA提交了該產品的首個上市申請,此申請得到來自2100多名接受TrenibotE治療患者的臨牀研究數據的支持,其中包括兩項評估TrenibotE治療中度至重度眉間紋的關鍵性III期臨牀研究(M21-500和M21-508)以及一項III期開放標籤安全性研究(M21-509)。
III期研究的所有主要和次要終點均已達到,給藥後8小時即可快速起效(最早評估時間),且療效持續時間為2-3周。此外,無論是作為單次治療還是最多連續三次治療,TrenibotE的治療中出現的不良事件與安慰劑相似。