据IPO早知道消息,维立志博于2025年6月4日更新招股书,继续推进港交所主板上市进程,摩根士丹利和中信证券担任联席保荐人。
这意味着,维立志博或将成为“国内TCE领域第一股”。
维立志博成立于2012年,是一家临床阶段生物科技公司,专注于发现、开发及商业化用于治疗中国及全球肿瘤、自身免疫性疾病及其他重大疾病的创新疗法。
截至2025年5月28日,维立志博管线涵盖14款候选药物,包括针对肿瘤的3款单克隆抗体、4款双特异性抗体、2款抗体偶联药物(ADC)及1款双特异性融合蛋白,以及针对自免疾病的1款双特异性融合蛋白及1款三特异性抗体。
值得一提的是,维立志博基于LeadsBody™专有技术平台,已构建覆盖血液瘤、实体瘤及自免三大疾病领域的TCE产品矩阵。
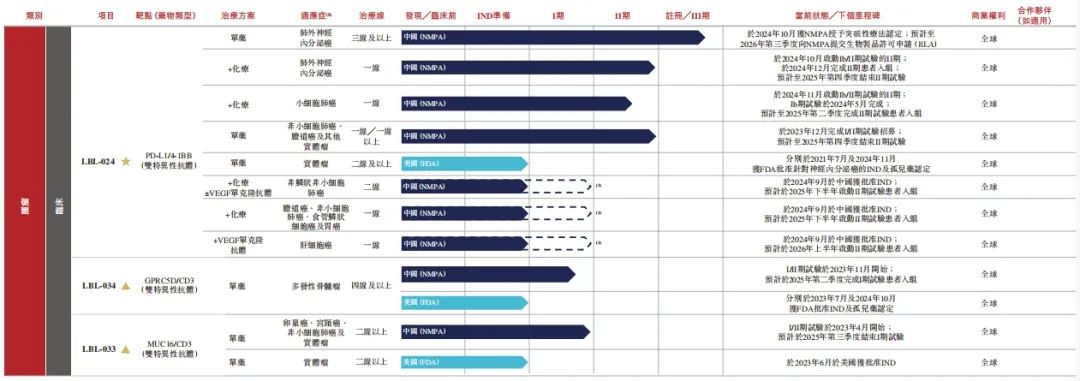
其中,维立志博有6款产品已进入临床阶段,包括1款核心产品及3款主要产品。
核心产品LBL-024为一款处于注册临床阶段的PD-L1与4-1BB双特异性抗体,是全球首个进入注册临床试验阶段的4-1BB靶向候选药物,旨在填补晚期肺外神经内分泌癌(EP-NEC)治疗的重大缺口。
该药物还获得了中国国家药监局和FDA的突破性疗法认定及孤儿药认定,目前正在进行多项针对晚期肺外神经内分泌癌、小细胞肺癌、胆道癌、非小细胞肺癌及其他实体瘤的临床试验,预计2029年提交肺外神经内分泌癌及小细胞肺癌一线治疗的生物制品许可申请(BLA)。
同时,维立志博主要产品LBL-034,是全球临床进度第二领先的靶向GPRC5D的CD3 TCE,在临床前研究中展现出良好疗效信号和较高的GPRC5D结合亲和力及效力,同时也降低了T细胞免疫疲劳风险及对健康细胞的损害。
在复发性/难治性多发性骨髓瘤单药疗法的I/II期试验中表现出了优异的客观缓解率等数据,有望为多发性骨髓瘤的治疗提供更优越的疗效及更长的治疗窗口期。
主要产品LBL-033,是全球仅有的两款已进入临床阶段的MUC16/CD3双特异性TCE抗体之一,用于治疗MUC16高表达的实体瘤,特别是卵巢癌、宫颈癌及子宫内膜癌等妇科癌症。
其独特的分子设计可提高靶向特异性,减少靶向非肿瘤毒性,降低有害免疫应答的风险,在单药疗法的I/II期试验中初步显示出良好的疗效和安全性。
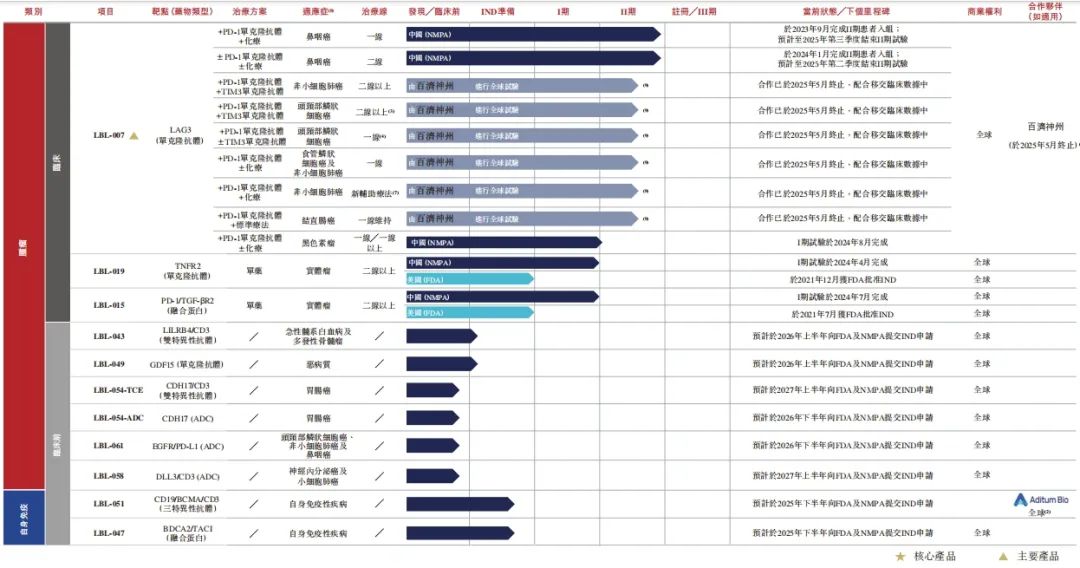
另一款主要产品LBL-007,在全球处于临床阶段的LAG3靶向单克隆抗体中临床进度位居前三,是首款被证实对鼻咽癌有效的同类抗体。
在联合替雷利珠单抗治疗一线鼻咽癌患者的II期试验中,展现出较高的客观缓解率、疾病控制率等积极数据,有望为鼻咽癌患者提供更有效的治疗选择。
在出海合作方面,2024年11月,维立志博与Aditum Bio就LBL-051(CD19xBCMAxCD3三特异性TCE抗体)达成NewCo合作,总价值高达6.14亿美元。
成立至今,维立志博获得了恩然创投、正心谷、汉康资本、怀格资本、新希望医疗、龙磐投资、华方资本、新丝路资本、国泓、深创投等机构的投资,于2024年完成的C+轮投后估值为31.3亿元。