得益于政策利好及医保支付边际改善等因素,近期港股创新药板块热度持续居高不下,多只港股医药ETF年内涨幅超过40%,领跑同类产品。5月29日,国家药品监督管理局一天内集中批准了11款创新药上市,标志着中国创新药行业已进入集中上市期。
在创新药板块受到多方关注之际,一家创新药企业赴港IPO可谓“恰逢其时”。据港交所公开文件披露,赣州和美药业股份有限公司(简称 “和美药业”)向港交所主板递交上市申请,国证国际为其独家保荐人,投资方包括真灼投资、上海鸿富、君联资本、泰格医药、倚锋资本等。
公开资料显示,和美药业成立于2002年,是一家创新驱动的生物制药公司,致力于发现和开发针对自身免疫性疾病和肿瘤的小分子药物,并在银屑病、白塞病和炎症性肠病和创新化学疗法开发中处于行业前沿地位。目前和美药业已经完成了6轮融资,最新一轮投后估值39亿元。
截至最新财务报告,和美药业仍未实现盈利,于2023年度及2024年度,公司收益分别约为405万元、529.8万元(单位为人民币,下同),主要来自政府补助,同期年内亏损则分别约为1.56亿元、1.23亿元。
如和美药业这般以18A规则上市的生物医药企业通常具有高投入、高产出的特点,候选药物的商业化前景将成为影响企业长期估值水平的重要因素。和美药业此次上市是否能赢得市场青睐,还是需要从其研发管线来看。
银屑病新药能否从激烈竞争中“突围”?
对于一家创新药企,衡量其未来成长潜力的关键就在于其研发管线。
智通财经APP了解到,截至最新披露日,和美药业已开发七个小分子候选药物,针对具有高度未满足需求的自身免疫和肿瘤疾病。截至2025年5月21日,其中四种处于II期、III期临床试验或NDA阶段,适用于12种适应症。
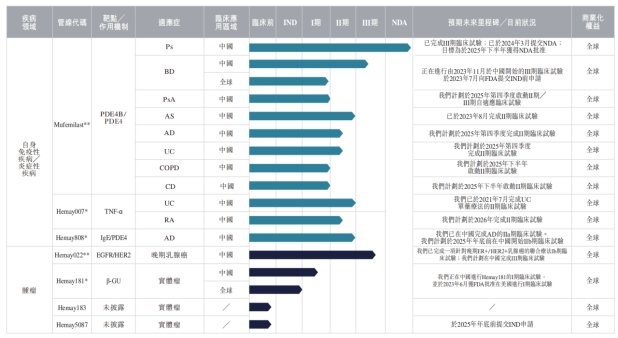
和美药业共拥有两款核心产品,有望成为全球首创银屑病治疗药物的Mufemilast和EGFR/HER2双靶点抗癌药Hemay022。
其中,Mufemilast是一种新型小分子磷酸二酯酶4B(PDE4B)蛋白表达阻断剂和PDE4抑制剂,具有广泛的自身免疫性疾病治疗潜力。其不会引起血管炎,也不会轻易穿过血脑屏障,从而减少了中枢神经系统副作用,如抑郁和自杀倾向。截至2025年5月21日,Mufemilast也是唯一可直接用于有潜伏性结核感染的银屑病(Ps)患者的药物,其安全性获III期临床试验支持。
截至2025年5月21日,公司已于中国完成Mufemilast作为单一疗法治疗Ps的关键性III期临床试验,且于2024年3月就Mufemilast作为Ps治疗提交的NDA正在接受优先审评;正在进行白塞病(BD)的关键性III期临床试验;已完成强直性脊柱炎(AS)的II期临床试验。
此外,就克罗恩病及慢性阻塞性肺病而言,公司正计划在中国开展II期临床试验,预期将于2025年下半年开始招募首批患者;溃疡性结肠炎(UC)和特应性皮炎(AD)的非关键性II期临床试验正在进行中。
而谈到Mufemilast的商业化前景,其进展最快的适应症为银屑病,这是一种常见于膝盖、肘部、颈部和头皮的皮肤病,是一种自身免疫性疾病。吸烟率的上升、生活方式的改变、饮酒量的增加等因素都可能导致各年龄段人群中银屑病发病率增加。数据显示,2024年,全球银屑病药物市场规模为296.21亿美元,预计在2024-2029年预测期内该市场将以9.19%的复合年增长率增长。
智通财经APP了解到,目前全球银屑病药物按治疗类型分为局部用药、系统疗法和生物制剂。随着对银屑病发病机制认识的深入,近年来各种生物制剂、小分子靶向药和外用药相继涌现。
而在生物制剂中,银屑病药物可主要分为白细胞介素(IL)抑制剂、肿瘤坏死因子α(TNF-α)抑制剂和磷酸二酯酶4(PDE-4)抑制剂等,其中Mufemilast就属于PDE-4抑制剂。但相比于传统的PDE-4抑制剂,Mufemilast具有PDE4B蛋白表达阻断剂和PDE4抑制剂的双重机制,与单独使用PDE4抑制剂相比,潜在副作用较低,治疗效果也较好。
在PDE-4抑制剂这一赛道,全球市场上已有由美国安进公司(Amgen)生产的全球首个口服PDE-4抑制剂阿普米斯特片,该药堪称银屑病治疗领域的革命性药物。自2014年3月获FDA批准上市以来,阿普米司特片的适应症不断扩展,先后用于治疗活动性银屑病关节炎、光疗和系统疗法中的中度至重度斑块型银屑病,早在2022年其全球销售额就已达到22.88亿美元。
在国内,2025年4月阿普米司特片已通过第十批国家集采,资料显示,该批集采药物价格平均降幅超60%。此外,截至目前,已有十余家企业研发的阿普米司特仿制药在国内成功上市,如齐鲁制药、正大清江制药等都有相关上市产品。

(图:阿普米司特片中选结果)
尽管Mufemilast相对于传统PDE-4抑制剂有一定优势,但在国内市场,各种各样的银屑病新药仍然层出不穷,如三生国健、信达生物都已有银屑病新药上市申请获得CDE受理。在现有市场竞争已经相当激烈的情况下,Mufemilast即使成功上市也将面临“前有狼后有虎”的困难境地,其商业化前景仍属于未知之数。
和美药业的另一款核心产品Hemay022是一种新型EGFR/HER2双靶点小分子抑制剂,旨在治疗晚期乳腺癌。Hemay022与芳香化酶抑制剂联合使用时,通过抑制HER2和EGFR的异常激活发挥其抗肿瘤作用,同时减少雌激素分泌。此外,在ER+/HER2+乳腺癌患者中,Hemay022联合内分泌治疗有助于推迟获得性耐药的发生。截至2025年5月21日,公司正在进行一项针对晚期ER+/HER2+乳腺癌的III期联合疗法临床试验。
作为蛋白酪氨酸激酶家族成员,表皮生长因子受体(EGFR)和人表皮生长因子受体2(HER2)在细胞信号转导中发挥核心作用,这两种受体的过表达或异常活化与多种实体瘤发生密切相关,已成为抗癌药物开发的重要靶点。
目前全球范围内已有多个EGFR/HER2双抑制剂进入临床阶段,如德国勃林格殷格翰公司开发生产的第二代不可逆EGFR/HER2抑制剂阿法替尼,对罕见EGFR突变有很好的疗效,能控制和预防脑转移,且对肺鳞癌也有一定的治疗作用;尼妥珠单抗(nimotuzumab)、甲苯磺酸拉帕替尼(Lapatinib Ditosylate)、莫博赛替尼(mobocertinib)等EGFR/HER2双抑制剂也已早早获批上市,Hemay022未来的竞争压力同样不容小觑。
此外,和美药业管线中还有多项研发中产品,如TNF-α小分子调节剂Hemay007,已完成单药治疗UC的II期临床试验,正在进行RA的II期临床试验;靶向IgE和PDE4的新型分子实体Hemay808,已于中国完成治疗AD的IIa期临床试验,计划在2025年年底于中国启动IIb期临床试验;一种潜在同类首创且具有专有作用机制的拓扑异构酶I靶点SDC药物Hemay181,具有广谱抗肿瘤潜力,已于2023年6月获FDA批准在美国进行I期临床试验,正在于中国进行I期临床试验。
多项研发中产品将为公司带来不小的资金压力,2023-2024年,公司研发投入分别为1.23亿元和0.97亿元,截至2024年12月31日公司持有现金和现金等价物约1.5亿元,高额的研发开支导致公司财务状况较为紧张,这或许也是和美药业急于上市的原因之一。
小结
整体来看,尽管公司核心产品银屑病新药进展较快,但该赛道已存在多款已上市和即将上市药物,激烈的市场竞争或显著挤压其商业化空间。与此同时,多项在研管线仍处高投入阶段,将持续对公司财务状况形成压力。在商业化前景尚存不确定性的情况下,和美药业想要赢得资本市场青睐恐非易事。