眼科药物开发历来被称为“黄金赛道”,已上市产品可通过延长专利期,或开发更多新适应症以扩大市场,保持优势地位。
据弗若斯特沙利文报告披露,目前全球眼科药物市场快速增长,市场规模由2018年324亿美元增加至2022年的387亿美元,预计2027年达到570亿美元,于2032年将达到858亿美元,折合人民币来看,这也算千亿赛道了。
伴随着眼科赛道的高景气,想要跻身资本市场“眼科大军”的不知凡几。
根据智通财经APP了解,据港交所6月11日披露,CLOUDBREAK PHARMA INC.(拨康视云)第四次向港交所主板提交上市申请书,建银国际、华泰国际为其联席保荐人。该公司曾于2023年11月、2024年5月、2024年12月2日向港交所提交过上市申请书。
招股书显示,拨康视云是一间临床阶段眼科生物科技公司,致力于开发各种疗法。眼科是研究眼部结构、功能和疾病的医学分支。拨康视云首家主要营运实体Cloudbreak USA于2015年9月在美国注册成立及公司于2020年11月在开曼群岛注册成立。
目前,该公司已获四轮融资,融资额约1.54亿美元,投资机构包括高特佳、建银国际、鼎晖投资、远大医药等。C轮融资过后,拨康视云估值达到4.69亿美元,相当于36.6亿港元。
三年累计亏损2.95亿美元
拨康视云是一间临床阶段眼科生物科技公司,致力于开发各种疗法。眼科是研究眼部结构、功能和疾病的医学分支,目前已经建立一个由候选药物组成的创新的管线,覆盖眼睛前部和后部的主要疾病,其中有四款处于临床阶段的候选药物及四款处于临床前阶段的候选药物,管线中的所有候选药物均为自主研发。
公司的管线包括两款核心产品(CBT-001及CBT-009),均为自主开发。核心产品CBT-001适用于治疗翼状胬肉(一种良性增生性眼表疾病),公司分别于2022年6月及 2023年9月在美国及中国启动第3期多地区临床试验(“多地区临床试验”)。
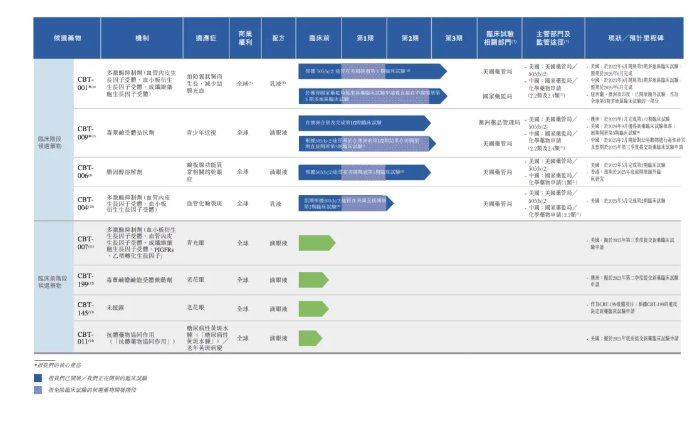
核心产品 CBT-009用于治疗青少年近视(5至19岁儿童及青少年近视),于2023年1月完成第1/2期 临床试验,并于2024年7月向美国食品及药物管理局(“美国药管局”)提交研究新药(“研究新药”)申请。公司拥有其他两个临床阶段候选药物CBT-006及CBT-004,及四款临床前阶段候选药物CBT-007、CBT-199、CBT-145以及CBT-011。
从上述招股书披露来看,公司产品均处于临床试验阶段。
从业绩来看,拨康视云是一间尚未录得收益的生物科技公司,其自成立以来及于整个往绩记录期产生净亏损,同时公司称可能于不久将来继续产生亏损,且可能无法实现或维持盈利能力。
数据显示,2022年、2023年及2024年(以下简称“报告期”),拨康视云年内亏损分别约为0.67亿美元、1.29亿美元、0.99亿美元,三年亏损2.95亿美元,约合21.2亿元人民币。
同时拨康视云在招股书中披露,预计2025年亏损净额将增加,主要是因为与将作出的以股份为基础的付款增加有关的员工成本预期增加等。
招股书显示,公司几乎所有亏损均来自其一般及行政开支、研发开支及按公平值计入损益的金融负债以及衍生金融工具的公平值变动。
据招股书,拨康视云一般及行政开支由2023年的0.11亿美元减少约180万美元或15.9%至2024年的约950万美元。
亏损背后,拨康视云仍在不断加码研发。
报告期内公司研发开支持续增长,分别为0.15亿美元、0.28亿美元及0.38亿美元。同年,核心产品CBT-001及CBT-009的临床研究开支分别为约760万美元、890万美元及1980万美元,分别占各期研发开支的49.4%、32.3%及52.2%,占各期营运成本总额31.2%、22.9%及41.8%。
与此同时,拨康视云期内经营活动的现金流量持续为负数,报告各期公司经营活动分别录得负现金流量约2010万美元、2250万美元及2650万美元。
根据智通财经APP了解,拨康视云整个经营史均需靠外部融资。然而由于C轮融资之后再没有获得新融资,导致其“外债”也越来越高。招股书还显示,拨康视云期内录得负债净额及流动负债净额,使其面临流动资金风险。公司报告期各期负债总额分别为2.27亿美元、3.28亿美元及3.92亿美元;流动负债净额分别为1.47亿美元、2.66亿美元及3.54亿美元,均持续上升。
总之,越亏越多,拖累拨康视云的各项财务指标陷入恶性循环,再度逐梦港股恐怕过程不易。
核心产品商业化前景难言明朗
正如上文所言,拨康视云已有四款处于临床阶段的候选药物,分别为CBT-001、CBT-009、CBT-006和CBT-004。上述产品一旦上市,撬动的成长空间恐怕也不容小觑。
在研管线中,CBT-001为拨康视云最成熟的核心产品,公司已于美国开展第3期多地区临床试验患者招募工作并完成中国临床试验机构挑选。CBT-001截至最后实际可行日期,并无临时数据可供分析。且公司预期美国及中国的第3期多地区临床试验将于2025年底完成。
弗若斯特沙利文报告显示,CBT-001对应的全球治疗翼状胬肉药物的市场规模预计将于2027年达到273.4百万美元及于2032年达到2,529.4百万美元,复合年增长率为56.0%。美国治疗翼状胬肉药物的市场规模预计于2027年达到135.9百万美元及于2032年达到1,416.6百万美元,复合年增长率为59.8%。中国治疗翼状胬肉药物的市场规模预计于2027年达到21.8百万美元及于2032年达到202.2百万美元,复合年增长率为56.1%。
截至最后实际可行日期,全球有3款适用于翼胬肉及减少结膜充血的临床阶段候选药物,其中2款处于第2期临床试验阶段及其中1款处于第3期临床试验阶段,即CBT-001。

然而,作为距离商业化最近的产品CBT-001,拨康视云已将部分权益让渡给远大医药。
招股书显示,2020年4月,拨康视云与远大医药签订了一份商业化许可安排,授予远大医药在大中华区生产和商业化CBT-001的独家、可转授权、含专利权费的许可,该许可适用于CBT-001的所有人类用途(包括预防翼状胬肉发展和减少结膜出血)。
而拨康视云则保留了上述地区上述适用领域以外CBT-001有关的所有权利,以及CBT-001的任何研发将由拨康视云进行,远大医药在未取得事先书面同意前不参与CBT-001的任何研发或就此作出贡献。不可否认的是,将部分权益让渡给远大医药可能会加速CBT-001的商业化进程,但另一方面,也会降低CBT-001对于拨康视云的盈利水平。更为重要的是,CBT-001的商业化最早也要在2025年以后,迟迟无法输血的拨康视云能等到吗?
综上来看,当下捉襟见肘的资金情况成为悬在公司头顶的一把利剑。如此情况更使得拨康视云冲刺IPO,成为一场不能输的战役。