红星资本局11月2日消息,随着减肥药赛道的竞争进入白热化,GLP-1领域明星产品替尔泊肽前三季度销售业绩出炉。
近日,美国制药公司礼来(LLY.N)公布了2025年三季报,受其GLP-1/GIP双靶点减重降糖药物替尔泊肽销量增长的推动,公司第三季度营收达到176亿美元,同比增长54%;前三季度总营收为458.87亿美元,同比增长46%。
值得注意的是,替尔泊肽前三季度为礼来贡献了248.37亿美元的收入,已经超过了默沙东(MRK.N)旗下明星抗癌药Keytruda(简称“K药”)前三季度销售额233.03亿美元。2024年,K药全球销售额约为295亿美元,创下新的销售纪录,蝉联“药王”。
替尔泊肽大卖248亿美元
已超越K药前三季度收入
10月30日,礼来公布了2025年三季报,第三季度实现营收176.01亿美元,与去年同期的114.39亿美元相比增长约54%。综合前两个季度的业绩来看,礼来今年前三季度的总营收为458.87亿美元,同比增长46%。
从地区分布来看,前三季度美国市场收入306.04亿美元,同比增长43%;欧洲市场收入84.61亿美元,同比增长89%;日本市场收入14.78亿美元,同比增长18%;中国市场收入14.77亿美元,同比增长20%;其他市场收入38.67亿美元。
分治疗领域来看,礼来四大板块——心脏代谢健康、肿瘤、免疫、神经前三季度收入分别为337.29亿美元、67.69亿美元、37.06亿美元、9.32亿美元。心脏代谢健康板块下的明星产品替尔泊肽又贡献了超七成收入。
替尔泊肽降糖版Mounjaro第三季度销售额为65.15亿美元,同比增长109%,前三季度销售额为155.56亿美元,同比增长94%;替尔泊肽减重版Zepbound第三季度销售额为35.88亿美元,同比增长185%,前三季度销售额达到92.81亿美元,而去年同期为30.18亿美元。两款替尔泊肽前三季度收入达248.37亿美元。
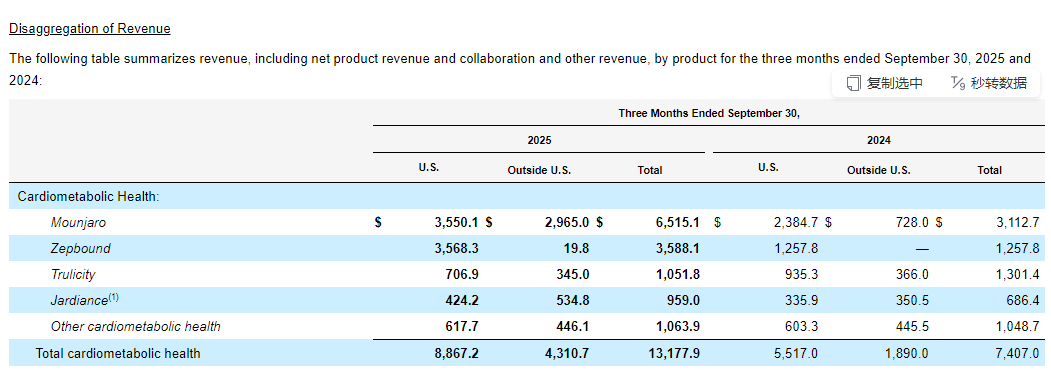
截图自礼来财报
礼来在财报中提到,Mounjaro与Zepbound的收入增长得益于需求增加,尽管美国市场存在价格下调压力,但销量增长对冲了毛利率承压。据公开报道,今年2月,礼来美国市场宣布,通过自费药房平台LillyDirect将Zepbound价格降至499美元/月,其中2.5mg规格单剂量小瓶装降至349美元/月。
与礼来同日披露三季报的还有另一家制药巨头默沙东。默沙东财报显示,明星抗癌药帕博利珠单抗(Keytruda,简称“K药”)三季度销售额为81.42亿美元,前三季度销售额为233.03亿美元。由此看来,替尔泊肽今年前三季度收入已超越K药。值得一提的是,2024年K药全球销售额约为295亿美元(约合人民币2149亿元),创下新的销售纪录,蝉联“药王”。
此前口服减肥药临床数据未达预期
国内减肥药市场迎来大批玩家
回顾替尔泊肽的上市步伐,2022年5月,替尔泊肽(商品名:Mounjaro)在美国FDA获得批准上市,用于改善成人2型糖尿病患者的血糖控制;2023年11月,FDA再次批准替尔泊肽(商品名:Zepbound)用于慢性体重管理。今年1月2日,替尔泊肽注射液(商品名:穆峰达)在中国正式上市,同时覆盖2型糖尿病和减重两项适应症。
红星资本局注意到,近年来,替尔泊肽也在追赶着诺和诺德(NVO.N)的明星产品司美格鲁肽,后者属于GLP-1R单靶点药物,但上市时间更早。目前诺和诺德还未披露三季报,对比上半年数据,司美格鲁肽销售额为1127.56亿丹麦克朗(约166.83亿美元),超越K药的151.61亿美元,同期两款替尔泊肽总销售额为147.34亿美元。
今年1月,诺和诺德旗下的全球首个口服GLP-1药物诺和忻在中国获批上市。今年8月7日,礼来公布了口服GLP-1药物Orforglipron的三期临床数据,患者用药72周后平均实现减重12.4%,由于此前市场对于这款口服减重药数据预期更高,当日礼来股价重挫14.1%,创多年最大单日跌幅。
目前,GLP-1领域已成“兵家必争之地”,国内市场也正在迎来大批玩家。今年9月,恒瑞医药(600276.SH)公告称,其子公司福建盛迪医药有限公司自主研发的HRS9531的药品上市申请,已获国家药监局受理。值得一提的是,HRS9531同样是GLP-1/GIP双重受体激动剂,目前全球范围内获批上市的GLP-1/GIP双受体激动剂仅礼来的替尔泊肽。
今年6月和9月,信达生物(1801.HK)与礼来共同开发的一款GCG/GLP-1双受体激动剂玛仕度肽在国内先后获批了减重和2型糖尿病的适应症,成为全球首个也是唯一同时获批用于体重管理和2型糖尿病治疗的GCG/GLP-1双受体激动剂。今年8月,信达生物宣布口服小分子GLP-1R激动剂IBI3032的新药临床试验申请(IND)获美国FDA批准。
(文章来源:红星资本局)